Gentherapie
1. Gründe für eine Gentherapie
Mit konventionellen Behandlungsmethoden lassen sich meist nicht die eigentlichen Krankheitsursachen, sondern nur deren Symptome bekämpfen. Besonders, wenn ein Gendefekt die Ursache der Krankheit ist, bleibt mit derzeitigen Therapieformen eine wirkliche Heilung unmöglich. Das heißt für viele Patienten, dass sie ein Leben lang Medikamente zu sich nehmen müssen.
Seit den 70er Jahren wird nun an der direkten Therapie der Gene, das heißt den Ersatz des defekten Genes durch ein gesundes, geforscht.
Beispiel: Bei einer besonders schweren Form der Immunschwäche gehen weiße Blutkörperchen zugrunde. Den Zellen fehlt ein bestimmtes Enzym, die Adenosin-Desaminase (ADA). Mit dem Ausfall der weißen Blutkörperchen bricht das Immunsystem zusammen, die Patienten haben normalerweise kaum Überlebenschancen und sterben sehr früh an einfachen Infektionen. Dieser Defekt ist auf ein einziges defektes Gen zurückzuführen. Lediglich die Aufnahme des künstlich hergestellten Enzyms ADA ermöglicht ein Überleben unter „normalen“ Umständen. Damit die betroffenen Patienten nicht permanent ADA von außen zu sich nehmen müssen verfolgte man den gentherapeutischen Ansatz, den Körper selbst wieder dieses Enzym herstellen zu lassen. Mit entschärften Viren schleuste man ein gesundes ADA-Gen in Zellen des Patienten (erstmals 1986 durchgeführt).
Potentielle Anwendungen der Gentherapie
ADA-Mangel, Mukoviszidose oder Hypercholesterinämie, eine Fettstoffwechselstörung, sind Beispiele für Erbkrankheiten, die von einem einzigen defekten Gen verursacht werden. Diese Krankheiten haben, aufgrund des genau definierten genetischen Defektes, die besten Chancen auf Heilung durch Gentherapie. Ein anderer wichtiger Anwendungsbereich sind erworbene Erkrankungen wie Tumoren, Herzinfarkt oder Viruserkrankungen, bei denen man die genetische Steuerung des Krankheitsverlaufes kennt.
2. Gentherapie-Arten
In der Testphase befindet sich derzeit nur die somatische Gentherapie. Dabei werden therapeutische Gene in betroffene Organe oder Körperzellen eingeschleust (Gen-Addition). Dies ist allerdings nur möglich bei einer Gering- oder Nichtproduktion eines Proteins, jedoch nicht bei einer Über- oder schädlichen Fehlproduktion.
Bei der Keimbahn-Gentherapie würde das Gen in die Eizelle oder die Spermien eingebracht werden und sich damit auf die Nachkommen übertragen. Obwohl der Transfer von Genen in Fortpflanzungszellen bei Tieren regelmäßig angewandt wird (zum Beispiel beim Pharming oder bei der Herstellung transgener Mäuse), ist er beim Menschen in Deutschland verboten und mit Haftstrafen belegt.
2.1. Somatische Gentherapie
Die ex-vivo Methode bei der somatischen Gentherapie
Bei dieser Methode entnimmt der Arzt dem Patienten körpereigene Zellen (Stammzellen), schleust das therapeutische Gen mit Hilfe von Vektoren (Genfähren) ein, vermehrt die Zellen daraufhin im Labor und führt sie dem Patienten wieder zu. Diese sogenannte ex-vivo Strategie ist zum Beipiel zur Bekämpfung von Blut- oder Knochenmarkskrebs oder AIDS denkbar.
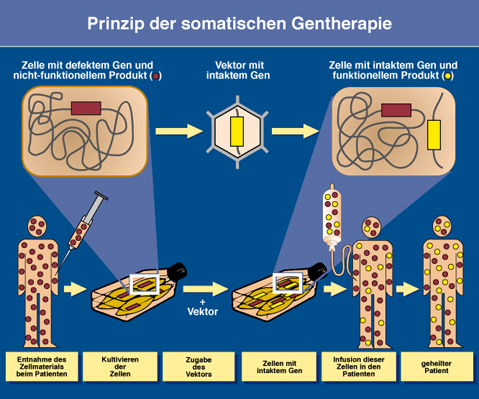
Die in-vivo Methode bei der somatischen Gentherapie
Bei der in-vivo-Strategie wird das Gen durch Vektoren direkt zum Zielort im Körper transportiert. Diese Genfähren können, entschärfte Viren sein, die Zellen zwar infizieren können und das therapeutische Gen dabei einschleusen, sich selber aber nicht mehr vermehren oder ausbreiten können. Retroviren haben sich als bisher bester Vektor erwiesen. Die viralen Gene, die den Aufbau des Virus codieren, wurden hierbei durch das therapeutische Gen ersetzt.
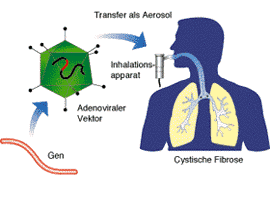
Bei der Inhalationstherapie der Mukoviszidose z.B. soll mit Hilfe von viralen Gentaxis das rettende Gen in die Lunge der Patienten eingeschleust werden, um dort den für die Krankheit typischen zähflüssigen Schleim abzubauen.
Zur Anwendung könnte das in-vivo-Prinzip unter anderem bei der Bekämpfung von Tumoren wie dem Gehirntumor Glioblastom kommen.
Zusammenfassend gibt es für den Transfer verschiedene Methoden (Vektoren), um ein therapeutisches Gen in eine Zelle zu transportieren:
Transfektion (physikalisch):
- Die Mikroinjektion bietet hohe Chancen für einen erfolgreichen Einbau des Gens (ca. 1:5), jedoch muss jede Zelle einzeln behandelt werden.
- Bei der Elektroporation macht ein Stromstoß die Zellmembran vorübergehend durchlässig, so dass die neue DNA in die Zelle eindringen kann. Bei dieser Methode können jedoch die Zellen stark geschädigt werden.
- Bei dem Partikelbeschuss werden kleine Goldkügelchen in die Zelle geschossen, auf deren Oberfläche die therapeutischen Gene haften. Auch diese Methode kann schwere Zellschäden hervorrufen.
Transduktion:
Hierbei bringt ein Virus das therapeutische Gen in die Zelle. Diese Methode eignet sich für die klinische Behandlung am besten.
Auch Liposomen, eine Art Fettkügelchen, die leicht mit Zellmembranen verschmelzen können, dienen als Gentaxis.
Allerdings sind die meisten der heute bekannten Vektorsysteme noch nicht ausgereift genug, um einen zuverlässigen Gentransfer zu gewährleisten. Sowohl die Pharmaindustrie als auch die Biomedizin versucht hier, bessere Grundlagen zu schaffen.
2.2 Keimbahntherapie
Unter Keimbahn versteht man Ei- und Samenzellen sowie ihre Vorläuferzellen. Keimbahntherapie ist ein therapeutisches Verfahren, das gezielt ein defektes Gen in der Keimbahn repariert. Diese genetischen Veränderungen werden auf die Nachkommen vererbt. Prinzipiell gibt es zwei Methoden: Erstens die homologe Ersetzung, also die Veränderung eines bestehenden Gens in einem bestehenden Chromosom.
Die zweite Methode, die so genannte "doppelte Addition", besteht aus der Einführung zusätzlicher Gene in einem zusätzlichen Chromosom in die Zelle. Weil es keine Interferenz (Überschneidung) mit den Genen einer Zelle gibt, würde die doppelte Addition mit geringerer Wahrscheinlichkeit zu unerwünschten Störungen der Zusammenhänge zwischen ihnen führen.
Beispiel für homologe Ersetzung:
In der Familie eines Paares treten häufig schwere Fälle von Dickdarmkrebs auf. Die Eltern in spe wollen ihr Kind vor dieser Krankheit schützen und entschließen sich zu einer Keimbahntherapie.
Ein Arzt entnimmt dem Mann Vorläuferzellen von Spermien. In die Zellen baut er ein Gen für ein "Selbstmordprogramm" ein. Dieses kann auf Knopfdruck gestartet werden, wenn durch ein Medikament zwei Schalter vor dem Gen aktiviert werden.
Die Spermienvorläuferzellen werden in eine Maus eingepflanzt, die eine große Zahl menschlicher Spermien "ausbrütet".
In einer Petrischale befruchten die Spermien die Eizellen der Frau.
Die Zellen beginnen sich zu teilen. Der Arzt pflanzt einen Embryo in die Gebärmutter ein. Nach neun Monaten erblickt ein gesunder Sohn das Licht der Welt. In all seinen Zellen befindet sich das eingepflanzte Gen.
Nach zwanzig Jahren diagnostiziert ein Arzt bei dem Sohn Dickdarmkrebs.
Jetzt wird das Selbstmordprogramm gestartet. Das erste Schloss wird mit einem ins Blut gespritzten Insektenhormon “geöffnet”. Das zweite Schloss wird durch einen Stoff geöffnet, den ausschließlich Dickdarmzellen bilden. Das jetzt freiwerdende Gift greift alle bösartigen Dickdarmzellen an. Ehe übermäßig viele gesunde Zellen abgetötet sind, beendet der Arzt die Insektenhormonbehandlung. Die Giftproduktion endet.
Quellen:
www.lifescience.de
Referat über Gentechnik von Markus Manske
MBM + F “Biotechnologie - Basiswissen für Innovationen”